Referenzelektrode – Bezugselektrode
Referenzelektroden werden auch als Vergleichselektroden oder Bezugselektroden bezeichnet. Eine Bezugselektrode (Referenzelektrode) ist eine Halbzelle mit einem Elektrodenpotential, das sich schnell, reproduzierbar, konstant und über die Zeit stabil einstellt. Wenn Sie Potenziale angeben, sollten Sie immer angeben, gegen welche Bezugselektrode (Referenzelektrode) Sie das Potenzial bestimmt haben.
Wenn Sie normgerecht messen möchten, müssen Sie die Platinwasserstoffelektrode verwenden. Die Platinwasserstoffelektrode muss dabei an den Minus-Pol (Masse oder auch Com-Eingang) angeschlossen werden. Dem Masse-Eingang von Messgeräten wird das Potential null zugeordnet. Er stellt das Bezugspotential für alle Signal- und Betriebsspannungen dar.
Zu beachten ist bei der Platinwasserstoffreferenzelektrode, dass das Wasserstoffpotential vom pH-Wert der Messlösung abhängt.
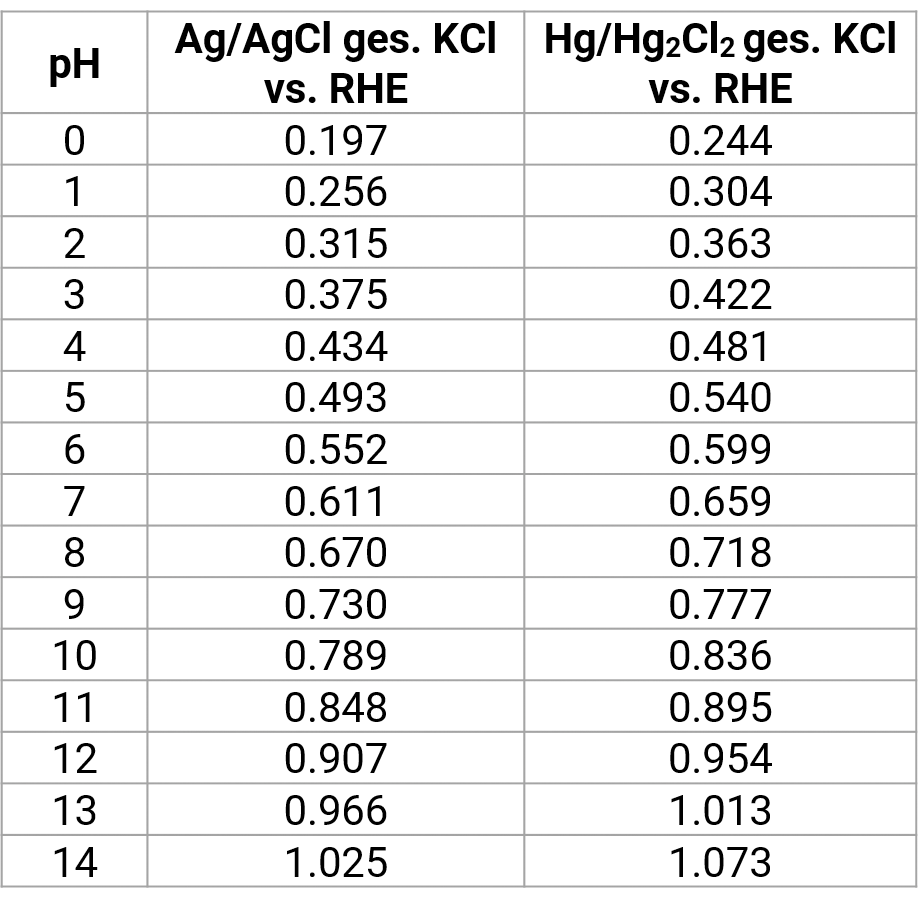
Das Wasserstoffpotential ist abhängig vom pH-Wert der Messlösung. Die Potentiale der Silberelektrode bzw. Kalomelelektrode sind hier gegen die Platinwasserstoffelektrode (RHE – reversible Wasserstoffelektrode auf Masse gelegt) aufgetragen. Bei einer Umpolung kehren sich die Vorzeichen entsprechend um.
HydroFlex – DIE Platinwasserstoffreferenzelektrode
Die Platinwasserstoffreferenzelektrode ist die Referenzelektrode (Bezugselektrode) erster Wahl, um normgerecht Potentiale zu messen. Platinwasserstoffelektroden sind die einzigen Referenzelektroden, die direkt die Wasserstoffionenaktivität messen. Es handelt sich um eine sogenannte Indikatorelektrode, wenn sie direkt in die Messlösung eintaucht.
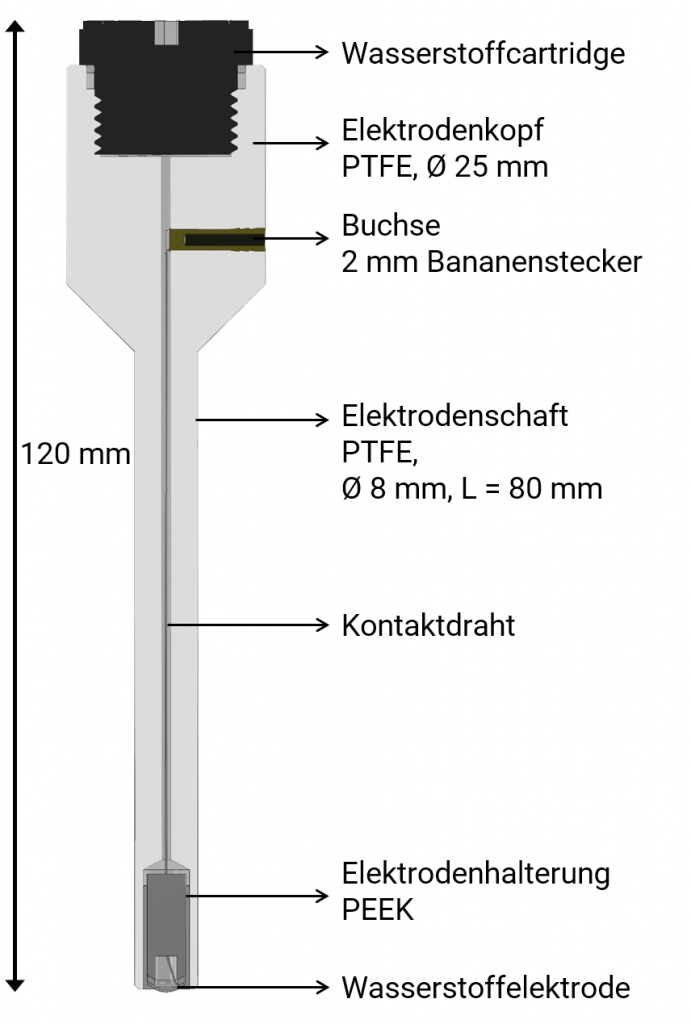
Diese Wasserstoffelektrode ist komplett aus PTFE gefertigt. Mit 120 mm Gesamtlänge ist sie gerad so groß wie ein Kugelschreiber und dadurch sehr handlich. Der Schaft hat einen Außendurchmesser von 8 mm und eine Länge von 80 mm. Durch Aktivierung der Wasserstoffentwicklungszelle (Cartridge) wird die Wasserstoffproduktion in Gang gesetzt und das Innere des PTFE-Rohrs mit Wasserstoff befüllt, bis dieser unten durch die Platinwasserstoffelektrode austritt.
Die Spannung wird an der vergoldeten Buchse im Elektrodenkopf abgegriffen. Multimeter zur Spannungsmessung sollten einen Eingangswiderstand von 5 MOhm und mehr haben. Unsere Referenzelektrode ist niederohmig, so dass keine abgeschirmten Kabel notwendig sind.
Sie kann bis zu Temperaturen von 210°C eingesetzt werden, solange nur der PTFE-Schaft diesen Temperaturen ausgesetzt ist.
Die Vorteile dieser handlichen Wasserstoffelektrode liegen klar auf der Hand.
Sie versorgt sich selbst über eine interne Quelle mit Wasserstoffgas, die einfach ausgetauscht werden kann. Sie enthält keinen Innenelektrolyten. Dadurch gibt es keinen Ionenaustrag und keine Diffusionspotentiale. Sie ist wartungsarm, denn es muss kein Elektrolyt nachgefüllt werden.
Sie enthält keine giftigen Schwermetalle.
Da sie aus PTFE hergestellt ist, kann sie in konzentrierten fluoridhaltigen Elektrolyten und in stark sauren bzw. stark alkalischen Medien (pH -2 bis 16) verwendet werden.
Vor der Erstbenutzung muss die Wasserstoffelektrode HydroFlex aktiviert werden. Dadurch wird die Wasserstoffproduktion in der Wasserstoffentwicklungszelle in Gang gesetzt, der sich entwickelnde Wasserstoff befüllt das PTFE-Rohr und tritt unten aus der Platin-Palladiumelektrode aus. Dort stellt sich entsprechend der in der Lösung vorhandenen Ionen ein Wasserstoffpotential ein, welches über die vergoldete Buchse am Elektrodenkopf abgegriffen werden kann. Einmal aktiviert, läuft diese Wasserstoffelektrode sechs Monate durch.
Schritt-für-Schritt-Anleitung zur Inbetriebnahme der Wasserstoffelektrode
Die Wasserstoffquelle dieser Referenzelektrode muss vor dem ersten Gebrauch aktiviert werden. Für die Funktionsweise der Elektrode ist es notwendig, dass Sie folgende Schritte einhalten:
Die Kennzeichnung mit der Seriennummer sowie den Aufkleber mit dem Aktivierungsdatum bitte nicht entfernen.
Download - Schritt für Schritt Anleitung zur Aktivierung der Wasserstoffelektrode HydroFlexInbetriebnahme der Wasserstoffelektrode
Aufbewahrung der Wasserstoffelektrode HydroFlex
Nach den Messungen spülen Sie die Wasserstoffelektrode gründlich mit Wasser ab. Bitte stellen Sie die Wasserstoffelektroden immer in eine Flüssigkeit – z.B. Messlösung, 1 mol/l Salzsäure, 1 mol/l Natronlauge – auch wenn Sie nicht messen. Die Wasserstoffelektroden dürfen nicht trocken an Luft gelagert werden! Wir empfehlen bei HydroFlex die Laufzeit nicht zu verändern.
Überprüfen der Funktionsfähigkeit von HydroFlexAustausch der Cartridge bei HydroFlex
Die Funktion der Wasserstoffelektrode ist solange gewährleistet, wie Wasserstoff produziert wird (Laufzeit). Nach Erreichen der eingestellten Laufzeit, wir empfehlen 6 Monate, muss bei HydroFlex die Wasserstoffquelle ausgetauscht werden. Ein Überschreiten der Laufzeit kann zu Schäden der Gasdiffusionselektrode führen und ist unbedingt zu vermeiden.
Sollte ein Wechsel der Wasserstoffcartridge nicht möglich sein, muss die Wasserstoffelektrode aus der Flüssigkeit herausgenommen und solange trocken aufbewahrt werden, bis eine neue Wasserstoffcartridge eingesetzt werden kann.
Mit einem SW21-Ringschlüssel können Sie die alte Wasserstoffquelle entfernen und durch eine Neue ersetzen. Achten Sie beim erneuten Einbau auf den richtigen Sitz des Dichtungs-O-Rings. Dieser darf sich nicht herausdrücken. Dichten Sie das Schraubgewinde mit einem Universalfett (z.B. Korasilon-Paste hochviskos). Die verbrauchte Wasserstoffquelle ist als Batteriemüll zu entsorgen.
Komplettreinigung der HydroFlex
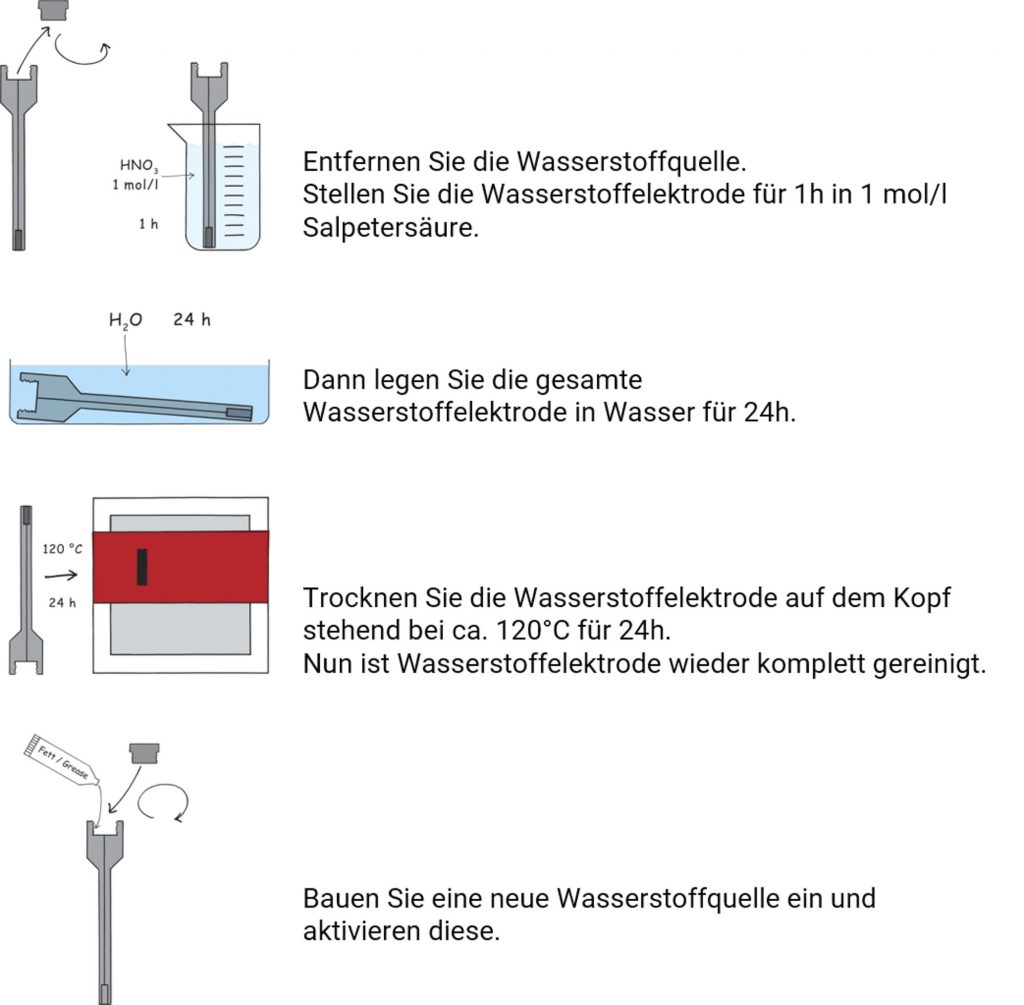
In seltenen Fällen wie z.B. bei sichtbaren Ablagerungen auf der Elektrode, ist eine Komplettreinigung der Wasserstoffelektrode erforderlich.
Download - Komplettreinigung der HydroFlex
Das Potential wird nicht richtig anzeigt.
Ursache 1: Schlechte Kontaktierung
Überprüfen Sie die Messkabel auf optische Schäden wie Korrosion, Risse und festsitzende Stecker. Tauschen Sie die Kabel aus. Überprüfen Sie die Elektrode mit Hilfe einer externen Referenzelektrode, z. B. einer Kalomel- oder Silbersilberchloridelektrode.
Ursache 3: Träger Ionenaustausch, z.B. beim Wechsel von konzentrierten Lösungen zu schwach konzentrierten Lösungen
Einstellzeit abwarten – manchmal dauert der Ausgleich von Konzentrationen einfach viel länger als erwartet. Gegebenenfalls, das Potential in einem anderen Elektrolyten wie z. B. 1 mol/l Salzsäure überprüfen.
Ursache 2: Keine oder zu geringe Wasserstoffproduktion
Haben Sie die neue HydroFlex für 24 h in die Messlösung gestellt?
Falls nicht, dann bitte 24 Stunden warten, bevor Sie messen!
Ist die Laufzeit der Wasserstoffquelle überschritten?
In diesem Fall tauschen Sie die Wasserstoffcartridge aus.
Ursache 4: Luft/Sauerstoff tritt an die Wasserstoffelektrode
Vermeiden Sie, dass Gase wie Luft oder Sauerstoff vor oder an die Wasserstoffelektrode unten im Schaft gelangen. Auf diese Weise wird der Wasserstoff verdrängt oder reagiert ab. Es kann sich kein Wasserstoffpotential einstellen.
Die Potentiale schwanken, rauschen oder schwingen.
Ursache 1: Wasserstoffblasen der Wasserstoffelektrode selbst.
Aus der Wasserstoffelektrode treten kontinuierlich Gasblasen aus. Diese sind mal sehr klein, manchmal aber auch größer. Im Regelfall stören diese Ihre Messungen nicht. Bildet sich unten an der Wasserstoffelektrode eine große Blase aus, die an der Gefäßwand hängenbleibt? Positionieren Sie die Wasserstoffelektrode, wenn möglich, weiter weg vom Gefäßrand oder hängen Sie die Wasserstoffelektrode schräg in das Messgefäß.
Ursache 2: Eingeleitete Gase
Verändern Sie die Position Ihres Gaseinlasses. Eingeleitete Gasblasen, die dicht an der Wasserstoffelektrode vorbeigeleitet werden, können die Messung stören und zu schwankenden Potentialen führen.
Ursache 3: Potentiotstat bzw. Messgerät
Überprüfen Sie Ihr Messgerät. Wenn Sie in schlecht leitenden Elektrolyten messen, kommen die Messgeräte und Potentiotstaten sehr schnell an ihre Grenzen. Weitere Information zum Thema Rauschen in elektrochemischen Messungen finden Sie hier: What-can-cause-my-experiment-to-be-noisy
Ablagerungen (z.B. rote oder braune) auf der Elektrode
Ursache 1: Wasserstoffelektrode ist verunreinigt, und es stellt sich ein Mischpotential ein.
Kontrollieren Sie die Laufzeit der Wasserstoffquelle. Gegebenenfalls muss die Wasserstoffcartridge wie in 4 Wartung ausgetauscht werden.
Manche Anlagerungen können mit einem Tuch abgewischt werden.
Hartnäckigere Verunreinigungen lösen sich in 1 mol/l Salpetersäure. Danach muss die Elektrode gründlich in destilliertem Wasser abgespült werden.
Gegebenenfalls können Sie eine Komplettreinigung durchführen.
Sollten die Reinigungsschritte zu keinem Erfolg führen, ist die Elektrode leider so verunreinigt, dass wir einen Neukauf empfehlen.
Mini-Wasserstoffelektrode – Mini-HydroFlex
Für Anwendungen auf engsten Raum haben wir unsere Wasserstoffelektrode weiterentwickelt und verkleinert. Aufbau und Funktionsweise entsprechen unserer großen Wasserstoffelektrode HydroFlex – nur eben kleiner.
Die Mini-HydroFlex ist einsetzbar bis 80°C und arbeitet natürlich ebenfalls ohne Innenelektrolyten.
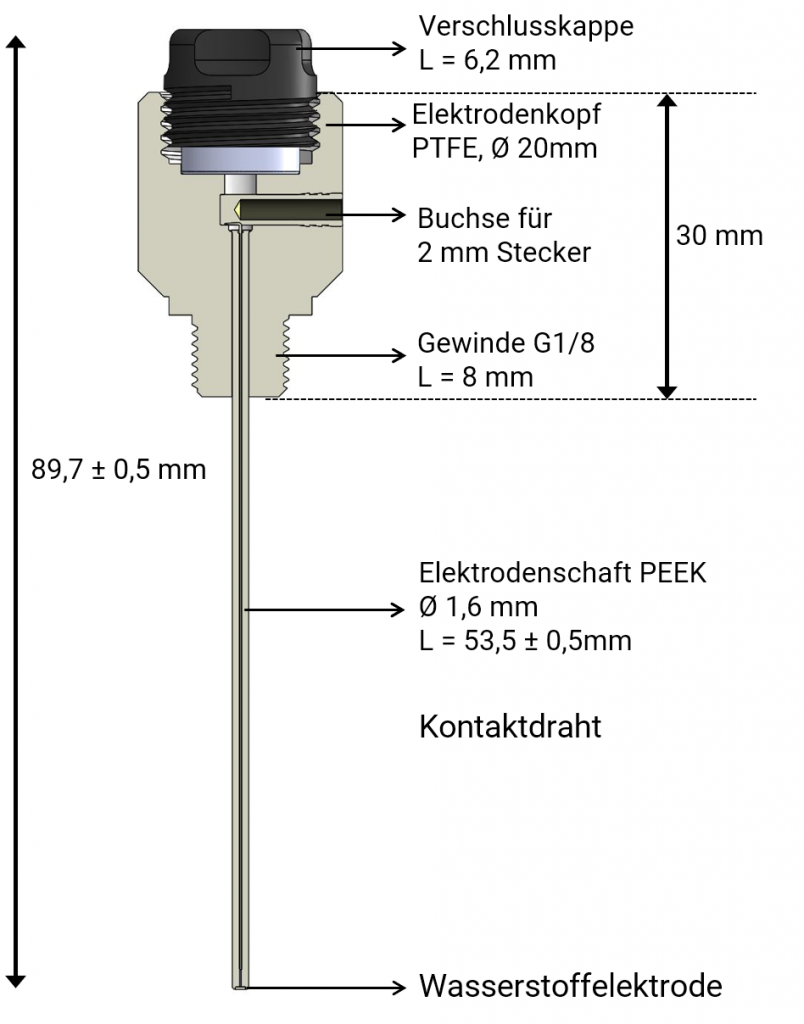
Derzeit bieten wir die Mini-Wasserstoffelektrode als PEEK-Kapillare an.
Die Kapillare hat einen Durchmesser von 1,6 mm und erlaubt damit den Einsatz von Mini-HydroFlex in kleinen Öffnungen.
Die Standardlänge der Kapillare beträgt 53,5 mm, andere Längen sind gegen Aufpreis möglich.
Somit kann Mini-HydroFlex entsprechend Ihren Wünschen individualisiert werden.
Bevor Sie messen wollen, müssen Sie die mitgelieferte Wasserstoffzelle (Knopfzelle) in den Elektrodenkopf einlegen und die Mini-Wasserstoffelektrode für 24 Stunden in Wasser stellen.
Die Kennzeichnung mit der Seriennummer sowie den Aufkleber mit dem Aktivierungsdatum bitte nicht entfernen.
Download - Schritt für Schritt Anleitung zur Inbetriebnahme der Mini-Wasserstoffelektrode Mini-HydroFlex
Aufbewahrung der Wasserstoffelektrode Mini-HydroFlex
Nach den Messungen spülen Sie die Mini-Wasserstoffelektrode gründlich mit Wasser ab. Bitte stellen Sie die Wasserstoffelektroden immer in eine Flüssigkeit – z.B. Messlösung, 1 mol/l Salzsäure, 1 mol/l Natronlauge – auch wenn Sie nicht messen. Die Wasserstoffelektroden dürfen nicht trocken an Luft gelagert werden!
Austausch der Wasserstoffzelle
Nach Erreichen Laufzeit von 12 Monaten muss die Wasserstoffknopfzelle ausgetauscht werden. Ein Überschreiten der Laufzeit kann zu Schäden der Gasdiffusionselektrode führen und ist unbedingt zu vermeiden. Sollte ein Wechsel der Wasserstoffzelle nicht möglich sein, muss die Wasserstoffelektrode aus der Flüssigkeit herausgenommen und solange trocken aufbewahrt werden, bis eine neue Wasserstoffzelle eingesetzt werden kann.
Download - Austausch der Wasserstoffzelle in Mini-HydroFlex
Das Potential wird nicht richtig anzeigt.
Ursache 1: Schlechte Kontaktierung
Überprüfen Sie die Messkabel auf optische Schäden wie Korrosion, Risse und festsitzende Stecker. Tauschen Sie die Kabel aus. Überprüfen Sie die Elektrode mit Hilfe einer externen Referenzelektrode, z. B. einer Kalomel- oder Silbersilberchloridelektrode.
Ursache 3: Träger Ionenaustausch, z.B. beim Wechsel von konzentrierten Lösungen zu schwach konzentrierten Lösungen
Einstellzeit abwarten – manchmal dauert der Ausgleich von Konzentrationen einfach viel länger als erwartet. Gegebenenfalls, das Potential in einem anderen Elektrolyten wie z. B. 1 mol/l Salzsäure überprüfen.
Ursache 2: Keine oder zu geringe Wasserstoffproduktion
Haben Sie die neue Mini-HydroFlex für 24 h in die Messlösung gestellt?
Falls nicht, dann bitte 24 Stunden warten, bevor Sie messen!
Ist die Laufzeit der Wasserstoffquelle überschritten?
In diesem Fall tauschen Sie die Wasserstoffzelle aus.
Ursache 4: Luft/Sauerstoff tritt an die Wasserstoffelektrode
Vermeiden Sie, dass Gase wie Luft oder Sauerstoff vor oder an die Wasserstoffelektrode unten im Schaft gelangen. Auf diese Weise wird der Wasserstoff verdrängt oder reagiert ab. Es kann sich kein Wasserstoffpotential einstellen.
Die Potentiale schwanken, rauschen oder schwingen.
Ursache 1: Wasserstoffblasen der Wasserstoffelektrode selbst.
Aus der Wasserstoffelektrode treten kontinuierlich Gasblasen aus. Diese sind mal sehr klein, manchmal aber auch größer. Im Regelfall stören diese Ihre Messungen nicht. Bildet sich unten an der Wasserstoffelektrode eine große Blase aus, die an der Gefäßwand hängenbleibt? Positionieren Sie die Wasserstoffelektrode, wenn möglich, weiter weg vom Gefäßrand oder hängen Sie die Wasserstoffelektrode schräg in das Messgefäß.
Ursache 2: Eingeleitete Gase
Verändern Sie die Position Ihres Gaseinlasses. Eingeleitete Gasblasen, die dicht an der Wasserstoffelektrode vorbeigeleitet werden, können die Messung stören und zu schwankenden Potentialen führen.
Ursache 3: Potentiotstat bzw. Messgerät
Überprüfen Sie Ihr Messgerät. Wenn Sie in schlecht leitenden Elektrolyten messen, kommen die Messgeräte und Potentiotstaten sehr schnell an ihre Grenzen. Weitere Information zum Thema Rauschen in elektrochemischen Messungen finden Sie hier: What-can-cause-my-experiment-to-be-noisy
Ablagerungen (z.B. rote oder braune) auf der Elektrode
Ursache 1: Wasserstoffelektrode ist verunreinigt, und es stellt sich ein Mischpotential ein.
Kontrollieren Sie die Laufzeit der Wasserstoffquelle. Gegebenenfalls muss die Wasserstoffzelle ausgetauscht werden.
Manche Anlagerungen können mit einem Tuch abgewischt werden.
Mit Schleifpapier der Körnung 1000 können Sie die Elektrode unten vorsichtig abschleifen.
Hartnäckigere Verunreinigungen lösen sich in 1 mol/l Salpetersäure. Danach muss die Elektrode gründlich in destilliertem Wasser abgespült werden.
Sollten die Reinigungsschritte zu keinem Erfolg führen, ist die Elektrode leider so verunreinigt, dass wir einen Neukauf empfehlen.













 English
English